Proprietați fizice + utilizări
Alcani 
Starea de agregare
În condiții standard (25ºC și 1 atm):
- primii patru termeni (C1-C4) și neopentanul sunt gaze.
- alcanii, începând cu termenii mijlocii, inclusiv C17 sunt lichizi
- cei superiori sunt solizi;
Punctele de fierbere și de topire
Punctele de fierbere cresc cu creșterea catenei, scad cu ramificarea deoarece ramificarea catenei alcanilor scade tăria interacţiunilor intermoleculare.
Punctele de topire cresc cu creșterea catenei dar mai puțin uniform decât punctele de fierbere(excepție C1-C3) [1, pag 22-23].
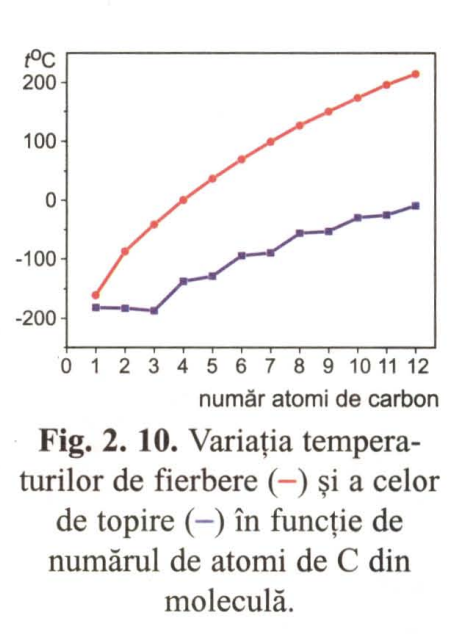
Exemplu aranjare în ordine crescătoare a punctelor de fierbere al unor compuși:
Izobutan < butan < neopentan < pentan < hexan
Solubilitate
Insolubili în apă, solubili în solvenți organici (nepolari, alcanii fiind la randul lor nepolari) de exemplu: benzina , benzen, tetraclorura de carbon (CCl4), cloroform (CHCl3). La rândul lor ei sunt buni solvenți pentru grăsimi;
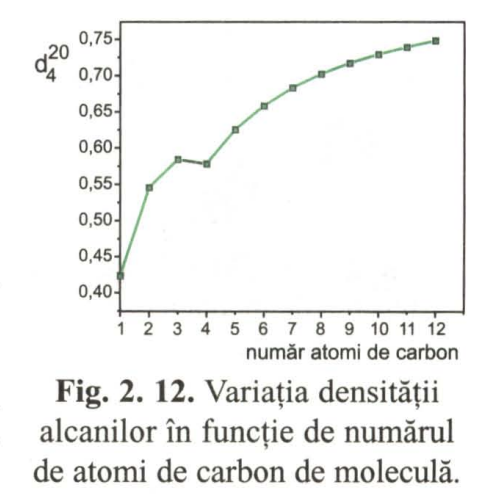
Densitate
Densitatea lor este mai mică decât a apei (plutesc deasupra apei);
Miros
Alcanii inferiori sunt inodori și incolori, iar cei superiori au miros caracteristic. Pentru a depista scurgerile de gaz din conducte sau din butelii se adaugă amestecului gazos format din alcani, compuși organici care conțin în moleculă sulf. Aceștia se numesc mercaptani și au miros neplăcut. Alcanii inferiori se extrag din gaz de sonda. Alcanii mijlocii, cicloalcanii si arenele se extrag din petrol.
Alcanii inferiori formează cu aerul amestecuri detonante = “gaz grizu” în cazul metanului.
Metanul se mai numeste gaz de baltă și se poate găsi în gaze naturale, gaze de sondă, de cocserie, în mine de carbuni.
În petrol se pot găsi alcani și arene.
Alcanii pot fi utilizați drept solvenți, materie primă în industria chimică, combustibili etc.
Gazul metan, aragazul (amestec de propan şi butan), butanul sunt folosite pentru încălzirea locuinţelor, gazul natural şi aragazul pentru pregătirea hranei, iar benzinele pentru punerea în mişcare a vehiculelor echipate cu motoare cu combustie internă.
Alchene 
Starea de agregare
In conditii standard, primii trei termeni (C2-C4) sunt gaze. Alchenele, incepand cu termenii mijlocii, inclusiv C18 sunt lichide, iar cele superioare sunt solide.
Punctele de fierbere si de topire
Cresc cu cresterea catenei, scad cu ramificarea( cu excepții în cazul termenilor inferiori unde regula aceasta pentru variația punctului de topire nu se aplică). Sunt puțin mai mici decat cele ale alcanilor cu același număr de atomi de carbon.
volume_upAtenție
Izomerii cis au puncte de fierbere, densitati si solubilitati mai mari decat izomerii trans dar izomerii trans au puncte de topire mai mari decat izomerii cis! Izomerii geometrici au p.f mai mari decat izomerii lor de pozitie fara geometrie.
Solubilitate.
Insolubile in apa, solubile in solventi organici (alcani, benzen, cloroform)
Densitate
Densitatea lor este mai mica decat a apei dar mai mare decat a alcanilor corespunzatori
Alte proprietăți și utilizări:
Oxidul de etenă obținut este toxic și se utilizează ca insecticid și ca materie primă pentru obținerea numeroaselor sinteze.
Glicolul obținut (atenție - a nu se confunda cu glicocol, care este un aminoacid), se utilizează la fabricarea PET-ului(Polietilentereftalat) și ca agent antigel.
Prin polimerizarea etenei se obține polietenă sau polietilenă care este utilizata la fabricare de folii (pungi, saci, etc.), țevi, obiecte de uz casnic si altele.
Alchine 
Stare de agregare
Termenii inferiori gazoși (C2->C3 + 1butina), termenii mijlocii lichizi (2butina-C17), termenii superiori solizi.
Punctele de fierbere și de topire
Cresc cu creșterea catenei, scad cu ramificarea, dar ceva mai mari decât ale alchenelor şi alcanilor cu același număr de atomi de carbon.
Solubilitate.
Insolubile în apă, solubile în solvenți organici. Excepție fac alchinele marginale inferioare care sunt parțial solubile ȋn apă.
Densitate
Densitatea lor este mai mica decât a apei dar mai mare decât a alchenelor corespunzatoare.
Excepție: Densitate etenă 0.92 > Densitate acetilenă 0.90
Aciditate
Caracter slab acid în cazul alchinelor marginale.
Acetilena pură este incoloră și are miros eterat.
Acetilena este un compus polar, instabil din punct de vedere termodinamic, la comprimare se descompune prin explozie in carbon şi hidrogen
HC≡CH → 2C + H2
Din acest motiv se transportă în butelii din oțel umplute cu azbest (o masa minerala poroasă) în care acetilena este dizolvată în acetonă la presiune de 15 atm.
Acetilena este extrem de solubila in acetona.
Solubilitate acetilena.
Cele două legături π crează o densitate electronică (δ ‾) la atomii de C implicați în tripla legatură.Ca urmare a acestei polarizări a moleculei, acetilena si alchinele inferioare sunt parțial solubile în apă. Solubilitatea lor crește odată cu creșterea presiunii și temperaturii, la acetilenă putând deveni solubilă în apă în raport 1:1,7 (în volume), în anumite condiţii de t° şi p;
Arene 
Benzenul - lichid incolor cu miros puternic specific, inflamabil și toxic, nu se poate oxida ușor de aceea este cancerigen inducând mutații genetice în organism.
Toluenul - lichid incolor cu miros specific, este un bun solvent, mai puțin toxic decât benzenul datorită proprietății de a se oxida la catena laterală de aceea se și recunoaște prin reacția cu KMnO4 a cărui soluție violetă o decolorează.
Prin oxidare în prezența enzimelor hepatice, se formează acidul benzoic, ușor de eliminat prin urină.
A fost izolat din balsam de Tolu.
Naftalina - substanță solidă cristalizată de culoare albă, cu miros specific. Sublimează!!!!
Sublimare = trecere din stare solidă direct in st. gazoasă.
Antracenul - substanță solidă, cristalizată, albă, cancerigenă.
Observați că arenele polinucleare sunt solide.
Punctele de fierbere - cresc cu creșterea Masei Molare, scad cu ramificarea laterală.
Punctele de topire - cresc cu simetria moleculară; de ex: benzenul>toluenul
Compușii aromatici au stabilitate termică ridicată
Solubilitate - Insolubile în apă, solubile în solvenți organici (alcooli, eter, acetonă, cloroform, clorură de metilen, hidrocarburi lichide)
Densitate - Densitatea arenelor mononucleare cu catenă nevoluminoasă este mai mică decât a apei dar mai mare decât a alchinelor. Restul arenelor, cu mase moleculare mari, au densitate mai mare decât a apei.
Numele de compuși aromatici provine de la mirosul aromat al acestora
Prin ardere (combustie /oxidare totala) se formeaza CO2 si H2O ca și la celelalte hidrocarburi.
Metode de obținere
-
Din surse naturale
Prin distilarea uscată a cărbunilor de pământ, gudronul de pamant prin distilare fracţionată și din petrol (idem pt alcani și cicloalcani, dar nu apar hidrocarburi nesaturate).
Derivati halogenati 
Stare de agregare:
-
Termenii inferiori ai compușilor halogenați sunt gazoși la temperatura camerei (CH3Cl, CF2Cl2, kelen) ;
-
Termenii mijlocii (>C3) și aromatici monohalogenați sunt lichizi dar și compușii cloroform - CHCl3 și solventul tetraclorură de carbon - CCl4;
-
Termenii superiori, polihalogenati sunt solizi ;
Solubilitate:
- Sunt solubili în solvenți organici (de ex hidrocarburi) și insolubili în apă. Doar câteva mici excepții sunt solubile în apă (fluorura de metil/etil, clorura de metil care au și masele cele mai mici) datorită legăturilor de hidrogen cu moleculele apei[R-F....H-OH).
Densitatea:
- Densitatea compuşilor halogenaţi este în general mai mare decât a apei și hidrocarburilor, crescând odată cu creşterea masei atomice a halogenului.
Freonii: gaz, ușor lichefiabil, stabil, netoxic, neinflamabili, necoroziv.
Derivații bromo și cloro se alterează la conservare, reacția este favorizată de lumină și de mediu acid ; se pastrează în sticle brune și se distilează înainte de utilizare. Sunt toxici acumulându-se în ficat şi în ţesuturile grase (sunt liposolubili).
Utilizare
-
O serie de derivați halogenați (diclorometanul, cloroformul, tetraclorura de carbon, dicloroetanul, di- și tricloroetena, clorobenzenul etc.) sunt solvenți pentru substanțe organice nepolare sau puțin polare (de ex grăsimi) ;
-
Mulți derivați halogenați au acțiune insecticidă, fiind folosiți chiar și în prezent, cu toate că, sunt în general compuși greu degradabili și pot produce poluarea îndelungată a solului sau apelor. Printre compușii care au fost cel mai mult utilizați sunt: p,p’diclorodifeniltricloroetanul (D.D.T), γ-hexaclorociclohexanul (“Lindan”)
-
Clorura de metil și freonul sunt agenți frigorifici.
-
Clorura de metil si cloroformul anestezice slabe
-
Cloroform - solvent pentru rășini, grăsimi
-
Kelenul anestezic in chirurgie
-
CCl4 – pulbere in extinctoare + solvent
-
Teflonul este un polimer rezistent la temperaturi înalte și agenți chimici.
-
Halogenurile de benzil sunt lacrimogene.
-
Clorura de vinil - la obținerea policlorurii de vinil(PVC) - masă plastică folosit la scară largă
-
DDT și lindan - insecticid
-
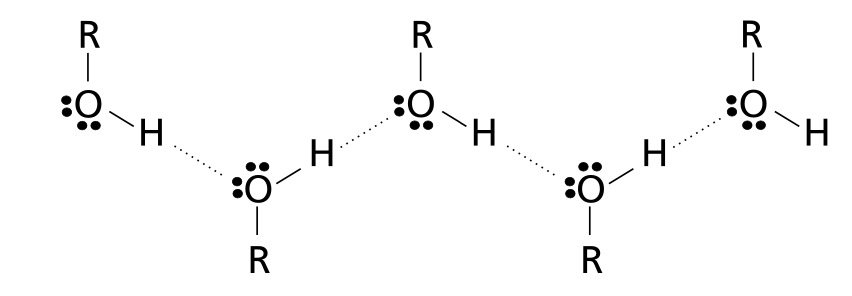
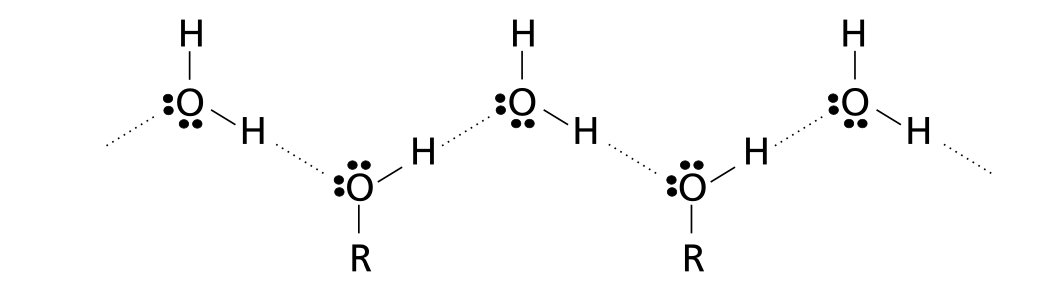
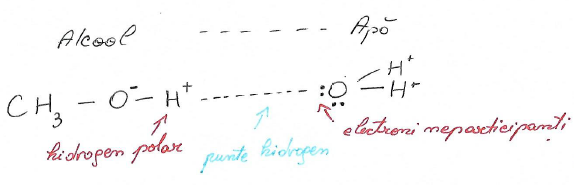
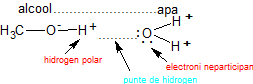
În stare lichidă și solidă alcoolii formează asocieri moleculare de tipul (R-OH). Moleculele asociate prin legături de hidrogen au puncte de fierbere și de topire ridicate, vâscozitate și tensiune de suprafaţă (tensiune superficială) mari ; Creează legături de hidrogen atât între ele cît și cu moileculele apei sau cu alți compușiu ce conțin oxigen în moleculă.
-
Formează:
-
legături de hidrogen intermoleculare(între alcooli sau compuși cu oxigen în moleculă):
- legături de hidrogen între moleculele alcoolilor și moleculele apei:
- legături de hidrogen intramoleculare pentru alcoolii cărora le permite strcutura
-
Alcoolii terțiari au pf., pt., < alcoolii secundari < alcoolii primari ;
-
Alcoolii inferiori (cu mase molare mici) sunt lichizi; de exemplu: metanol, etanol, glicerină ;
-
Alcooli au densitatea mai mică decât a apei dar mai mare decât a hidrocarburilor corespunzătoare ;
-
Punctele de fierbere ale alcoolilor sunt mult mai ridicate decat ale alcanilor corespunzatori și cresc cu creșterea numărului de grupe -OH din moleculă ;
-
Punctele de fierbere ale metanolului, etanolului și glicerinei cresc în ordinea:
p.f·metanol < p.f·etanol < P·f.glicerina ·
-
Termenii inferiori si mijlocii sunt solubili în apă, termenii superiori, insolubili.
Punți de hidrogen:
-
Solubilitate în apă
-
Puncte de fierbere ridicate
-
Solubilitate in acid
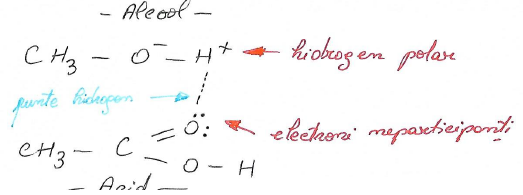
Electroni neparticipanti «p »

Exemple exerciții :
Care este raportul dintre electronii p/pi ?
-
p = electroni neparticipanti
-
pi (π) = electroni care formează legătura pi, pentru fiecare legătură pi avem câte doi electroni π. De exemplu legătura dublă are 2 electroni π, legătura triplă are 4 electroni π si ciclul aromatic are 6 electroni π
Metanolul 
-
Metanolul sau alcoolul metilic (CH3OH) se obţine industrial din gazul de sinteză (CO și H2).
-
Alcoolul metilic servește ca materie primă la fabricarea aldehidei formice, a unor intermediari în industria coloranţilor;
-
Se utilizează ca dizolvant pentru grăsimi, lacuri și vopseluri, poate provoca orbirea!!!
-
Este un lichid volatil foarte inflamabil și arde cu flacără albăstruie transformându-se în CO2 și H2O ;
-
Este toxic, doza letală de metanol pentru om este de aprox. 0,15g/kg corp;
volume_upAtenție
Metanolul nu e otravă dar se transformă în compuși toxici (aldehidă și acid formic). -
În urma intoxicației cu metanol se folosește ca antidot etanolul. (enzima acool dehidrogenaza din organism acționează asupra etanolului astfel încât metanolul rămâne netransformat și este eliminat din corp)
-
Are o putere calorică de 7000 kcal / kg,
-
Se mai numește alcool din lemn (s-a obținut din lemn prin distilare)
Etanolul
-
Etanolul sau alcoolul etilic C2H5OH se găsește în băuturi spirtoase și în spirtul medicinal;
-
Se obține din fermentarea enzimatică a glucozei (cu ajutorul unor bacterii din drojdia de bere).
-
Are punct de fierbere 78°C.
-
Se mai numește spirt alb
-
Are acțiune depresivă(acționează la nivelul membranelor celulelor nervoase) și anestezică, este un vasodilatator (se inroșeste pielea) și diuretic (deshidratare)
-
Prin metabolizarea lui în ficat se transformă în compuși toxici (aldehida acetica) ceea ce duce la crize hepatice și în urma expunerii prelungite, ciroza.
-
Produce dependență iar prin intoxicație → demență etilică și chiar moartea.
-
Dă reacție de recunoaștere cu dicromat de potasiu (din portocaliu → verde).
-
Utilizări: băuturi alcoolice, conservant, dezinfectant, solvent, combustibil, lichid termometre.
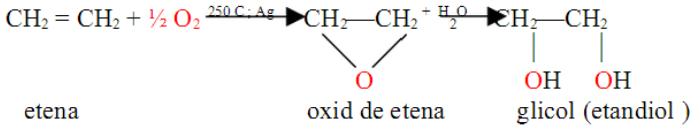
Etilenglicolul
Sau glicolul este un lichid vâscos cu gust dulce, miscibil cu apă în orice proporţie. Amestecat cu apa servește ca lichid pentru radiatoarele automobilelor deoarece asemenea amestecuri nu îngheaţă la temperaturi joase.
Glicerina
(1, 2, 3 – propantriol sau glicerol) apare ca produs secundar la obţinerea săpunului prin hidroliza bazică a grăsimilor.
-
Se obţine industrial din propenă ;
-
Glicerina este folosită ca dizolvant în cosmetică, în medicină, la fabricarea săpunurilor speciale, a explozivilor, la prepararea lichidelor antigel, la fabricarea unor rășini sintetice etc. ;
-
Este un lichid incolor, vâscos, cu gust dulce, inodor, solubil în apa și alcool. Fierbe la 2900C, deoarece având 3 grupe hidroxil formează un număr mare de legături de hidrogen.
-
Metodă industrială de obținere a glicerinei din propenă :
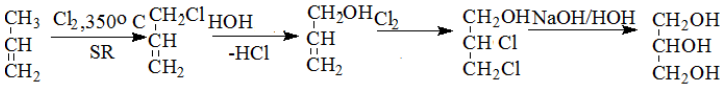
Diclorhidrina glicerinei
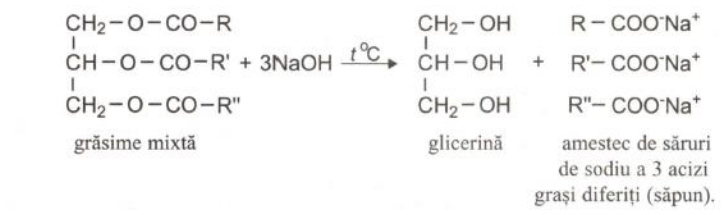
Obținerea grăsimilor și a săpunurilor
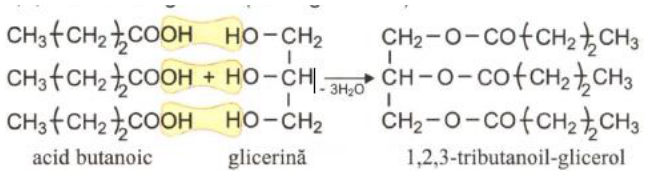
Hidroliza bazica (cu NaOH – soda caustica)
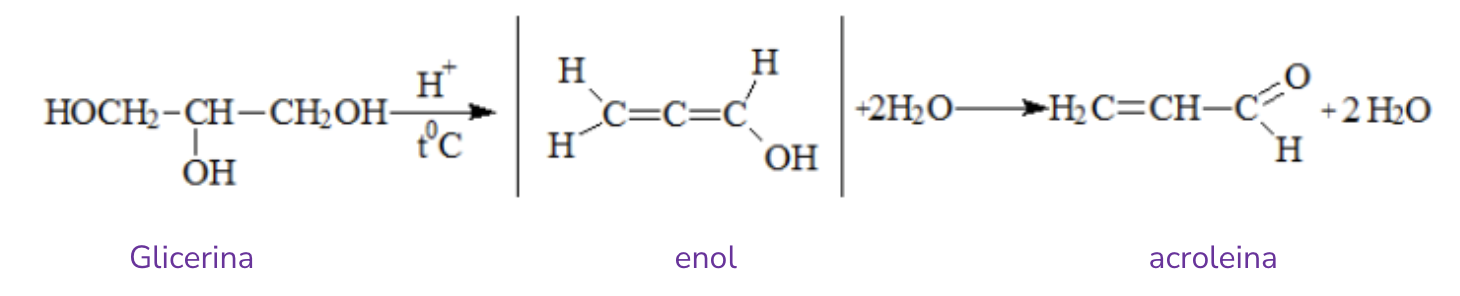
Obținerea acroleinei
Glicerina -> reacție de deshidratare
Fenoli 
Fenolul (benzenolul) se găsește în gudroanele cărbunilor este un produs incolor, solid, cristalizat în ace, cu miros specific. Este toxic, în contact cu pielea producând arsuri.Se utilizează pentru obţinerea fenoplastelor, coloranţilor, medicamentelor (aspirina). Dezinfectant.
Crezolii (o-,m,-p-metilfenolii) se separă tot din gudroane, ca fenolul. Au acţiune bactericidă mai puternică decât fenolul, deci sunt dezinfectanți.
Naftolii se găsesc de asemenea în gudroanele cărbunilor. Sunt foarte puţin solubili în apă dar se dizolvă în alcool și eter. Naftolii sunt folosiţi ca intermediari în sinteza coloranţilor.
Fenolii polihidroxilici nu se găsesc în natură dar se întâlnesc derivaţi ai lor în regnul vegetal. Fenolii polihidroxilici sunt compuși solizi, solubili în apă și alcool, greu solubili în hidrocarburi. Sunt mai reactivi decât fenolii monohidroxilici.
Rezorcinolul (rezorcina) este un compus cristalin, incolor, foarte solubil în apă. Rezorcinolul este un dezinfectant ușor, folosit în dermatologie.
Hidrochinona este folosită ca antioxidant, revelator fotografic, în dermatologie și cosmetică, ca antiseptic și conservant.
Hidrochinona și pirogalolul au proprietăți reducătoare.
Creolina = soluție apoasa de crezol
Pirogalolul se găseşte în diferite produse vegetale sub forma de eteri. Pirogalolul în soluţie alcalină are afinitate pentru oxigen. Soluţiile alcaline de pirogalol, absorbind cantitativ oxigenul, sunt folosite la dozarea volumetrica a oxigenului. Este folosit şi ca revelator fotografic deoarece prin reducere se depune precipitat de Ag.
Amine 
Nitrobenzenul este un lichid slab gălbui, cu miros plăcut de migdale amare, cunoscut sub numele de „esență de mirban”, este insolubil în apă, solubil în alcool sau eter. Se folosesește pt obținerea anilinei, în industria coloranților, medicamentelor, cosmetică.
Aminele inferioare sunt gaze (metilamina, dimetilamina, trimetilamina, etilamina) si au miros de amoniac.Aminele superioare sunt lichide majoritatea, iar unele amine aromatice cu doua sau trei nuclee aromatice sunt solide si inodore.Aminele lichide si diaminele au miros neplacut de pește.
Numai termenii inferiori în fiecare serie sunt solubili în apă: odată cu creșterea radicalului hidrocarbonat (hidrofob) insolubilitatea în apă se accentuează;
Aminele primare dezvoltă legături de hidrogen intermoleculare mai slabe decât alcoolii și fenolii deoarece azotul are electronegativitate mai mică decât oxigenul, totuși suficient de puternice deci vor avea puncte de fierbere și de topire mai scăzute decât ale compușilor hidroxilici dar mai ridicate decât cele ale hidrocarburilor corespunzătoare;
Aminele primare si secundare pot stabili legături de hidrogen intermoleculare. Aminele pot stabili legături de hidrogen cu moleculele apei sau cu alți compuși care au hidrogen implicat în legătura polară;
CH3-O- – H+ - - - - - - - - - - -:NH2 - CH3
Pf., cresc cu nr grupărilor amino și scad de la amine primare, la amine secundare, la amine terțiare (scad cu ramificarea);
Aminele aromatice, precum anilina, au punctele de fierbere mai joase decât restul, datorită imposibilităţii de a crea legături de hidrogen puternice. Tot de aceea solubilitatea lor în apă este redusă, deşi se dizolvă în solvenţi organici. Aceste amine sunt toxice şi sunt foarte uşor absorbite prin piele
Amine cu miros pestilențial:
H2N-(CH2)n-NH2
PUTRESCINA (n = 4), CADAVERINA (n = 5);
Amine (foarte) cancerigene:
-
β-Naftilamina, Benzidina;
ANILINA – este un lichid incolor care în timp, la contactul cu oxigenul din aer, prin autooxidare, capătă culoarea galben-brună (se oxidează la nitrobenzen). Este puțin solubilă în apă. A fost izolata din gudroane.
Aminele au hibridizare sp3 la atomul de carbon si configurație triedrică, cu o pereche de electroni neparticipanți la azot într-un orbital sp3 si 3 legături sigma. In cazul sărurilor cuaternare de amoniu, azotul poate realiza 4 legături deci capătă configurație tetragonală.
Utilizări ale aminelor
Anilina este cel mai important termen al seriei. Ea se foloseşte ca materie primă pentru industria coloranţilor, a medicamentelor şi a detergenţilor;
Aminele primare aromatice sunt materie primă pentru fabricarea coloranţilor. În reacţie cu acidul azotos (HNO2) formează sări de diazoniu, care se supun imediat (datorită instabilităţii) unor reacţii de cuplare, rezultand azoderivaţi. Aceştia sunt puternic coloraţi şi deci folosiţi in principal în industria textilă;
Carbonilici 
Formaldehida este gaz, acetaldehida și acetona sunt lichide;
Primii termeni ai seriei sunt solubili (miscibili) în apă (legături de hidrogen datorate hidrogenului polar al apei ce caută electroni neparticipanți de la O carbonilic) ;
volume_upAtenție
Compușii carbonilici între ei nu realizează legături de H dar realizează legături de hidrogen cu moleculele apei
Solubilitatea scade cu creșterea masei moleculare, de la 6 atomi în sus fiind aproape nulă . Sunt solubili în solvenți organici iar cei lichizi sunt la rândul lor solvenți foarte buni pentru lacuri, vopsele, mase plastice;
Miros caracteristic plăcut sau dezagreabil (benzaldehida are miros de migdale amare, acetaldehida miros de mere verzi în concentrații mici, dar miros înțepător în concentrații mari, acetona miros caracteristic, formaldehida miros înțepător de formol) ;
Punct de fierbere și de topire mai scăzute decât ale alcoolilor, apei și ale acizilor (legături dipol – dipol mai slabe si forțe Van der Waals de dispersie) dar mai ridicate decât ale hidrocarburilor. Cresc cu creșterea catenei.
Aldehidele au pf., pt. mai mici decât cetonele cu același număr de atomi de C ;
Soluția apoasă de formaldehida 30 – 40% se numește formol (formalina) ; Formaldehida este dezinfectant și gaz, și soluție, denaturează proteinele de aceea se folosește la conservarea preparatelor anatomice.
Acetaldehida se folosește la obținera acidului acetic și a butanolului (bun solvent).
Acetona se folosește ca dizolvant, pt solubilizare și extragere grăsimi, pt dizolvarea acetilenei, pentru obținere cloroform și metacrilat de metil. Solvent bun pt acetat de celuloză si nitroceluloză.
Iasmona – cetonă ciclică din uleiul de iasomie.
Aldehidele cu catena normala C8-C10 se gasesc in uleiurile eterice de trandafir si iasomie.
Aldehidele și cetonele inferioare sunt iritante și toxice, au efect narcotic, produc tulburări digestive.
Acetaldehida este folosită industrial pt obținerea alcoolului etilic prin hidrogenare catalitică (pe Ni).
Carboxilici 
Stare de agregare: C1 – C12 sunt lichizi; > C12 și aromatici sunt solizi, cristalini ;
Solubilitate: termenii inferiori sunt solubili în apă, solubilitatea scăzând cu creșterea catenei și ajungând ca acidul lauric (C12) să fie insolubil dar solubil in solventi organici (hidrocarburi, eteri);
Punctele de fierbere sunt anormal de ridicate și cresc monoton în serie. Sunt mai mari decât ale alcoolilor ;
Punctele de topire alternează în funcţie de numărul atomilor de carbon, acizii cu număr par având punctele de topire mai ridicate decât cei cu numar impar. Acizii cu număr par formează o reţea compactă, moleculele așezându-se paralel în reţea ca un „manunchi de creioane” ;
C1 – C4 sunt lichizi cu miros pătrunzător; C4 – C10 au miros neplăcut de sudoare; cei solizi sunt inodori ;
Acidul benzoic, acizii aromatici, sunt solizi, cristalizați, sublimează ;
Acidul acetic la 16,6 grade C și 99,5 % concentrație se solidifică, formează cristale --> acid acetic glacial. La 108o cristalizează, are deci puncte de fierbere și de topire scăzute.
Acidul acetic este incolor, în soluție slabă concentrată = oțet (acru) folosit pentru conservarea unor alimente.
Acidul acetic se folosește la obținerea mătăsii acetat, aspirină sau esteri cum ar fi acetat de vinil ce poate polimeriza mase plastice
Acid formic, acetic au miros înṭepător, termenii mijlocii au miros neplăcut iar termenii superiori și aromatici sunt inodori.
Acidul oxalic este folosit pentru dozarea calciului, obținându-se oxalat de calciu (COO)2Ca insolubil.
Acidul tereftalic se folosește pentru obținerea polietilentereftalatului (fibre sintetice).
Acidul salicilic este un acid cristalin, foarte solubil in apă.
Halogenuri acide 
Halogenurile acizilor inferiori sunt lichide cu miros înțepător, incolore; Halogenurile acizilor superiori sunt solide, se pot distila;
Au puncte de fierbere mai scăzute decât ale acizilor din care provin. Sunt insolubile în apă dar reacționează cu aceasta refăcând acidul;
Sunt foarte reactive (mai reactive decȃt anhidridele acide de aceea dau reacṭii mai energice), halogenul poate fi foarte usor înlocuit de diverse alte grupe.
Clorura de acetil si clorura de benzoil sunt reactanṭi foarte des întalniṭi în reacṭiile de acilare, de aceea se mai pot folosi ca şi nume de reacṭii: acetilare, benzoilare
Anhidride acide 
Termenii inferiori lichizi;
Termenii superiori solizi;
Insolubile în apă dar reacționează cu acestea.
Pf, Pt mai mari decat ale acizilor corespunzatori.
Esteri 
Esterii sunt substanțe lichide sau solide;Sunt substanțe solubile în solvenți organici, insolubile în apă;
Esterii inferiori au miros plăcut de fructe sau flori;
Se folosesc în industria cosmetică sau alimentară;
Au puncte de fierbere inferioare alcoolilor și acizilor din care provin deoarece nu fac asociații intermoleculare de aceea sunt usor volatili.
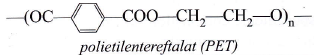
Amide 
Formamida e lichidă, termenii ceilalṭi sunt solizi, frumos cristalizați;
Amidele acidului formic sunt solubile în apă la orice temperatură, termenii superiori sunt solubili în apă la temperatură și alcool;
Puncte de fierbire mai mici decât cele ale acizilor datorită legăturilor de hidrogen mai slabe dar mai mari decât ale altor clase datorită legăturilor de hidrogen
Sunt substanțe neutre sau slab bazice (cele terțiare) / slab acide (cele primare și secundare).
![]() -poliamidă folosită la obṭinerea unor fibre sintetice.
-poliamidă folosită la obṭinerea unor fibre sintetice.
Zaharide 
Monozaharide
-
Sunt polare, solubile în apă;
-
La încălzire se caramelizează și apoi se carbonizează;
-
Au activitate optică (în special în soluție apoasă);
-
Glucoza este o substanță solidă, cristalizată, incoloră, cu punctul de topire de 167ºC. Glucoza ciclică poate exista sub două forme:
-
α-glucoza p.t 146°C
-
β-glucoza cu punct de topire 150°C
-
-
Glucoză se găseşte în:
-
Cantități mari în miere de albine, fructe dulci,
-
Cantități mici în sânge (0,06-0,10%), limfă, LCR.
-
În sânge normal este 0,06-0,11%), Peste o concentraţie de 0,16%, glucoza trece prin intermediul rinichilor în urină, producând glicozurie (diabet zaharat).
-
Glucoza este solubilă în apă puţin solubilă în alcool și greu solubilă în solvenți organici. La dizolvare, β-glucoza trece în α-glucoză.
-
Industrial, glucoza se foloseşte în medicină, la prepararea produselor zaharoase, gluconat de calciu, pastile vitamina C, în industria textilă sau la fabricarea oglinzilor.
-
Fructoza este mai dulce decât glucoza, este considerată unitate iar glucoza are 75% din puterea sa de îndulcire;
-
Gustul dulce creşte cu numărul grupărilor OH
-
L-glucoza şi L-fructoza nu se găsesc în natură. Ei sunt enantiomerii D-glucozei şi D-fructozei, mult mai răspândite. Marea majoritate a monozaharidelor naturale fac parte din seria D.
11. D-sorbitolul se găsește în multe fructe, cel mai abundent în sorbul de munte. Este folosit ca materie primă pt vitamina C.
12. D-manitolul este mai răspândit și se găsește în alge. Se folosește la obținerea rășinilor de tip gliptal și a uleiurilor sicative și sintetice.
Dizaharide
Maltoza se găseşte în natura în cantităţi mici în aproape toate plantele dar în cantităţi mari în plantele germinate (de ex orz încolţit). Este denumită zahăr de malţ şi se obţine industrial prin hidroliza enzimatica a amidonului, este un intermediar în fabricarea berii și a alcoolului etilic.
zaharoza
Denumire uzuală: zahăr. Zahărul solid se obţine din sfecla sau trestie de zahăr
Zaharoza se scindează prin hidroliză (în mediu acid sau enzimatic) într-o moleculă de glucoză și una de fructoză (fructoza este o monozaharidă izomeră de funcțiune cu glucoza):
![]()
zaharoza glucoza fructoza.
Amestecul de glucoză și fructoză rezultat după hidroliza zaharozei se numește zahăr invertit sau miere artificială.
Zaharoza este dextrogiră dar prin hidroliză rezultă un amestec levogir de zahăr invertit.
Zaharoza se topeşte prin încălzire uşoară. Prin răcire, zaharoza topită se transformă într-o masă amorfă, care încălzita peste 185°C devine brună (se caramelizează) şi apoi se carbonizează (devine neagră).
Tratată cu H2SO4 concentrat, zaharoza se carbonizează de asemenea. Acidul sulfuric este higroscopic (scoate apa din structura polihidroxilică a zaharozei, din care rămâne numai carbonul (cărbune poros).
1 g zaharoza = 3,7-4,2 kcalorii.
Poate fi hidrolizata de 2 enzime diferite:
- O α-glicozidaza (maltaza)
- O β-glicozidaza (invertaza)
Polizaharide
celuloza
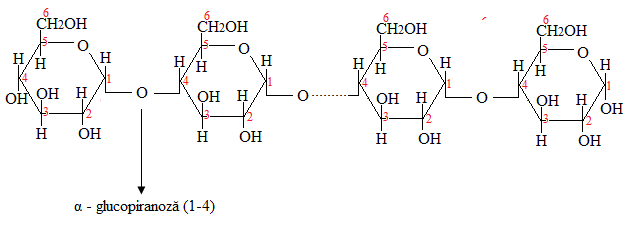
Polimer de β – D - glucopiranoză, legături β - (1,4) - glicozidice (n=300-3400);
-
Fiecare rest monozaharidic conține 3 grupe hidroxilice libere;
-
Caracter slab reducător(Grupele -OH sunt implicate în legături de hidrogen și de aceea sunt mai puțin reactive)
-
Rezistență mecanică crescută;
-
Substanţa solidă, albă, inodora, insipidă, slab higroscopica.
-
Insolubilă în apă şi în marea majoritate a solvenți organici;
-
Hidrolizată enzimatic de o β –glicozidază (emulsina)
-
Solubilă în reactiv Schweitzer – hidroxidtetraminocupric (Cu II)
[Cu (NH3)4(OH)2]
Reactivul are culoare albastră şi se obţine din CuSO4, NaOH şi amoniac.
-
Soluţia obţinută prin dizolvarea celulozei în reactivul Schweitzer, trecută prin orificii foarte înguste (proces de filare) şi apoi prin soluţie acidă, duce la obţinerea mătăsii artificiale (de tip mătase cuproxam)
-
Reacția de hidroliză (acizi minerali, temperaturi crescute);
-
Organismul uman nu are enzime pentru a hidroliza celuloză;
-
Celuloza are structură fibrilară;
-
Fiecare moleculă de celuloză are 1, 2, 3 posibilități de esterificare;
-
Formează scheletul ţesuturilor lemnoase ale plantelor superioare (copaci, dar şi iarba), le conferă rezistenta mecanică şi elasticitate. Fibrele celulozice sunt firele de bumbac. Se obţine din lemn, stuf, paie, etc. Este substanța organică cea mai abundentă cantitativ pe Pământ.
-
Atomii de oxigen din punţile eterice sunt orientaţi alternativ, de o parte şi de alta a axei macromoleculei şi, de aceea, au o orientare liniara, cu dispunerea paralelă a fibrelor şi realizarea unui număr mare de legături de hidrogen intre grupele hidroxil din macromoleculele învecinate. Fibrele sunt strȃns împachetate de aceea moleculele de apă nu pot pătrunde printre macromoleculele de celuloză şi aceasta nu este solubilă în apă.
-
Prin hidroliză din celuloză obținem:
Celuloză --›Celobioza --› β-D-glucoza
Este hidrolizată enzimatic de o β- –glicozidază (celulază).
xantogenatul de celuloza este utilizat pentru obținerea mătase artificială de tip mătase vâscoză și a celofanului (prin filare în mediu de acid sulfuric)
Amidon
Amidonul este o substanță neunitară, albă, amorfă, fără gust dulce, insolubil în apă rece, caracter slab redcător, alcătuit la rândul lui din 2 polizaharide importante: amiloza + amilopectina;
Este format din:
- Amiloza – miezul granulei de amidon, structura filiformă, legături α-glicozidice 1-4 între moleculele de glucoză, solubilă în apă caldă, dar insolubilă în apă rece, 10-20% din masa amidonului (n = 300-1200);
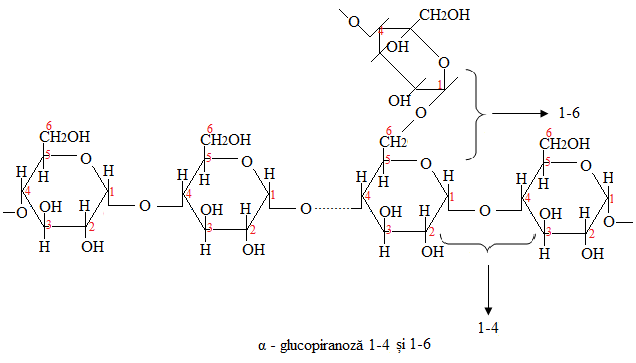
- Amilopectina – învelișul granulei de amidon, structura ramificată, resturi de α - glucoză legate 1-4 și 1-6, insolubilă în apă caldă, 80-90% din masa amidonului, (n=6000-36000);
În apă caldă, la 90°C granulele de amidon se umflă şi apoi se sparg formând soluţii vâscoase. La rece ele se transforma în gel numit coca sau clei de amidon. Coca este formată doar din amilopectina, insolubila în apă caldă.
În procesul de digestie, amidonul este hidrolizat în trepte până la D-glucoza. În cavitatea bucală, sub acţiunea α –amilazei salivare, amidonul este scindat în dextrine şi eventual maltoza. Acţiunea acestei enzime continua până în stomac unde este inactivata de aciditate. În intestin, intervine amilaza pancreatică ce hidrolizează amidonul până la dextrine (intermediar) şi maltoza. În final, maltoza este scindata de α-glicozidaza intestinala (maltaza) până la D-glucoză.
Glucoza este absorbită la nivelul intestinului subţire şi constituie principala sursă de energie a organismului. Excesul de glucoză este transformat în glicogen şi depozitat în ficat sau muşchi (într-o cantitate mai mică).
Amidonul este folosit la obţinerea etanolului, ca agent de încleiere şi apretare, aditivi în tablete şi pansamente, etc.
GLicogen
-
Structură asemănătoare cu cea a amilopectinei, dar molecula este mai mică şi mai ramificată decât la amilopectina
-
n=3000-6000;
-
Polimer de α - glucopiranoză legate 1-4 și 1-6;
-
Rezervă energetică;
-
Structură ramificată;
-
Excesul de glucoză este transformat în glicogen la nivelul ficatului;
-
Glicogenul este formă de stocare macromoleculară a glucozei pentru oameni și animale.